17) ორგანული ქიმია
ორგანული ქიმია — მეცნიერება, რომელიც შეისწავლის ნახშირწყალბადებსა და მათ წარმოებულებს.
სხვა სიტყვებით, რომ ვთქვათ, ორგანული ქიმია სწავლობს ყველა იმ ნივთიერებებს და მათ წარმოებულებს, რომელთა მოლეკულის შემადგენლობაში არსებობს თუნდაც ერთი ნახშირბადატომსა და წყალბადატომთა შორის კავშირი ან ასევე ორ ნახშირბადატომს შორის. აქედან გამომდინარე ჩვენ იოლად განვსაზღვრავთ თუ რომელი ნაერთი გახლავთ ორგანული და არაორგანული. ასე ქვემოთ მოცემული მაგალითიდან (იხ. ნახ 1) ჩანს, რომ ყველა ორგანულ ნაერთს გააჩნია მინიმუმ ერთი უშუალო კავშირი C (ნახშირბადატომსა) და H (წყალბადატომს) შორის.
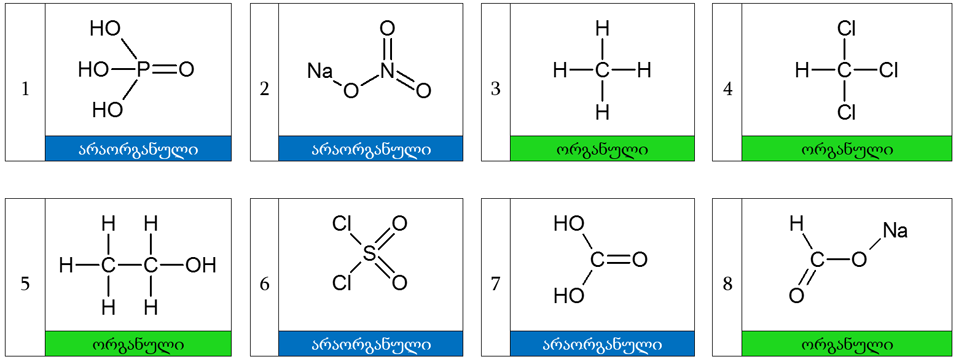
ნახ 1. ორგანულ და არაორგანულ ნაერთთა სტრუქტურული ფორმულების მაგალითები.
საერთოდ ნახშირბადის წყალბადნაერთთა
შესწავლა ცალკე (ორგანული) ქიმიის დარგად რამოდენიმე მიზეზით გახლავთ
განპირობებული,
ამ მიზეზთა შორის პირველ რიგში აღსანიშნავია
ნაერთის წარმოქმნაში მონაწილე, ორივე,
ელემენტების
ატომთა ელექტრონებისადმი სწრაფვის
უპირატესობის არ არსებობა.
(იხილეთ ნახ 2). ელემენტები, რომლებსაც არ გააჩნიათ ელექტრონისადმი სწრაფვის
გამოხატული უპირატესობები (გაცემისა და მიერთების თვალსაზრისით), მოლეკულის
სტაბილურად ზრდის შესაძლებლობას იძლევიან ვინაიდან
ასეთი მოლეკულის ძირითად ნაწილში
დაკავშირებულ ატომებს
შორის გაზიარებულ ელექტრონთა ღრუბელი ჯაჭვში თანაბრად არის გადანაწილებული
(ნახ 3).
|
 |
|
|
|
|
ნახშირბადატომების, სხვა ატომებისაგან განსხვავებით,
ერთმანეთთან დაკავშირების უნარი, შესაძლებელს ხდის სხვადასხვა სიდიდის
მაღალმოლეკულური ჯაჭვების წარმოქმნას. აღნიშნულმა გარემოებამ დასაბამი
მისცა სამყაროში უნიკალური თვისებების მქონე ნივთიერებების წარმოქმნას,
უპირატესად ბიონაერთების, რომელთა საფუძველზე გაჩნდა და არსებობს ჩვენთვის
ცნობილი სიცოცხლის ფორმის ყველა ნაირსახეობა.
18)
ნახშირწყალბადები და რადიკალები.
მოლეკულური სტრუქტურა. ჰომოლოგიური რიგი. ქიმიური თვისებები.
|
|
განხილული პრეზენტაცია №1 |
|
|
|
|
|
|
|
||
|
ნახშირწყალბადები:
ეწოდებათ ქიმიურ ნაერთებს, რომლებიც მხოლოდ ნახშირბადისა (C) და წყალბადისაგან (H) შედგებიან. აღნიშნულ ნივთიერებების შემადგენლობაში რომელიმე ატომის ჩანაცვლებით მიიღებიან ნახშირწყალბადების წარმოებულები. |
ორგანული ნივთიერებების მოლეკულურ სტრუქტურას, არაორგანულთან შედარებით, გააჩნია პრინციპული განსხვავება - ორგანულებში შესაძლებელია ერთნაირი ატომების ერთმანეთთან უშუალო დაკავშირება პრაქტიკულად განუსაზღვრელი რაოდენობით. ამ როლზე საუკეთესოდ გამოდის ნახშირბადატომი შემდეგი მიზეზების გამო:
©
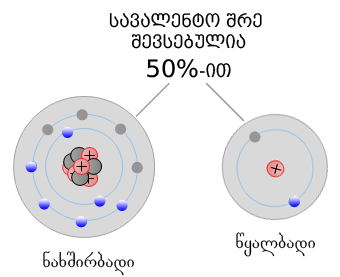
ნახშირბადატომების ბოლო ელექტრონული შრე შევსებულია 50%-ით;
© ნახშირბადი პოლივალენტურია - მას ერთზე მეტ ატომთან დაკავშირების
უნარი აქვს (განსხვავებით
წყალბადატომისაგან, რომელსაც ასევე ბოლო ელექტრონული შრე 50% ააქვს
შევსებული, ის ამასთან ერთად ერთვალენტიანია) და ამრიგად
შესაძლებელია ნახშირბადის საფუძველზე ატომთა შემოერთება გაგრძელდეს
ჯაჭვისებურად;
© ნახშირბადატომების დაკავშირებისას
საერთოდ არ არის დამახასიათებელი ელექტრონთა
სამუდამო გადასვლა სხვა
ატომის შემადგენლობაში (იონიზაცია) და მაკავშირებელი ელექტრონები ძირითადად
თანაბრად ნაწილდებიან (ზიარდებიან) მოკავშირე ატომებს შორის
კოვალენტურად;
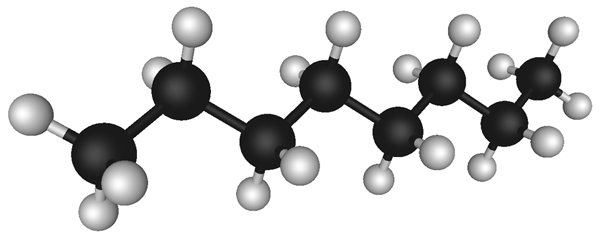
ნახშირწყალბადების კლასიფიკაცია
იოლი წარმოსადგენია, რომ ზემოაღნიშნული თვისებების ფლობის პირობებში ნახშირბადის ნაერთების საერთო რიცხვი მეტად შთამბეჭდავი სიდიდის იქნება. ამ, მხოლოდ ორი ელემენტისაგან შემდგარი, ნაერთების მოლეკულური სტრუქტურების სახეობებიც მრავალრიცხოვანია და ისინი ნაწილდებიან სხვადასხვა კლასიფიკაციებით მაგ.:
უპირველესყოვლისა აღსანიშნავია მარტივი კლასიფიკაცია შემადგენლობის მიხედვით:
-
ნაჯერი ნახშირწყალბადები — მათი ნახშირბადოვანი ჯაჭვი მხოლოდ მარტივი, ერთმაგი ბმებისაგან შედგება.
ნაჯერი ნახშირწყალბადების წარმომადგენლებია ალკანები; -
უჯერი ნახშირწყალბადები — ნახშირბადოვანი ჯაჭვი შეიცავს ერთ ან მეტ ჯერად (ორმაგ ან სამმაგ) ბმას.
უჯერ ნახშირწყალბადებს მიეკუთვნებიან ალკენები, ალკინები, არომატული ნაერთები და სხვა.
კლასიფიკაცია მოლეკულური აღნაგობის მიხედვით:
- წრფივი ნახშირწყალბადები — წრფივ ნახშირწყალბადებში ნახშირბადის არც ერთი ატომი არაა დაკავშირებული ნახშირბადის ორზე მეტ სხვა ატომთან (მაგ.: ალენები);
- განტოტვილი ნახშირწყალბადები — განტოტვილ ნახშირწყალბადებში ნახშირბადის თუნდაც ერთ ატომს დამყარებული აქვს ბმა ორზე მეტ ნახშირბადის სხვა ატომთან (მაგ.: იზოოქტანი);
- ციკლური ნახშირწყალბადები — ციკლურ ნახშირწყალბადებში ნახშირბადოვანი ჯაჭვი იხშვება საკუთარ თავთან და წარმოქმნის რგოლს (მაგ.: ციკლოჰექსანი).
მოცემული სასწავლო კურსის ფარგლებში შეყვანილია მხოლოდ ერთიდან ოთხი ნახშირბად ატომის შემცველი ნახშირწყალბადების ძირითადი (ზედაპირული) მახასიათებლების შესწავლა.
| ატომებს შორის დამატებითი ბმა გახლავთ უჯრი |
რადიკალები
რადიკალი (ლათ. radix - "ძირი", "საფუძველი") — ატომი ან ატომთა ჯგუფი, რომელთაც ბოლო ელექტრონულ შრეზე აქვთ გაუწყვილებელი ელექტრონი (და როგორც შედეგი შეუვსებელი ელექტრონული შრე). რადიკალების მნიშვნელოვანი განმასხვავებელი ნიშანია ელექტრონული მუხტების არ არსებობა, ვინაიდან მათში პროტონებისა და ელექტრონების რიცხვი ერთნაირია. ატომებისაგან რადიკალები განსხვავდებიან, როგორც აღინიშნა, გაუწყვილებელი სავალენტო ელექტრონების არსებობით, რაც მათ მაღალ რეაქციისუნარიანობას სძენს, ელექტრონული შრეების შეუვსებლობის გამო. აღნიშნული რეაქტიულობის გამო რადიკალების როგორც წესი თავისუფლად არსებობა ერთ წამზე ნაკლებ დროს ითვლის, ისინი პოულობენ ისეთ მოლეკულებს, რომელთანაც წარმოქმნიან შედარებით მდგრად ნაერთებს.
სანამ ნივთიერებები რეაქციაში ღებულობენ მონაწილეობას, ხდება მათი მოლეკულების შემადგენელ ნაწილებად დაყოფა და რეაქციის შედეგად ამ ნაწილების გადაწყობა ახალი ნივთიერებების წარმოქმნით. ნაერთების ზემოაღნიშნული დაყოფა შესაძლებელია განხორციელდეს ორიდან ერთ ერთი გზით (მექანიზმით) იხ. ნახ. 4, რაც მნიშვნელოვნად განპირობებულია ნაერთის შემადგენელი ელემენტების ელექტროუარყოფითობით. თუ შემადგენელი ელემენტებისათვის დამახასიათებელია ელექტრონის მიერთებისაკენ ან გაცემისაკენ დიდი სწრაფვა, მაშინ ასეთი ნაერთების დაშლა წარიმართება იონებად დაყოფის მექანიზმით (ნახ. 4, მაგ. 1), რომლის დროსაც ხდება ერთი სახის (A) ელემენტისაგან სხვა (B) ელემენტისათვის ელექტრონების გადაცემა. როგორც მოგეხსენებათ ელექტრონთა მიგრაციის (გადასვლის) შედეგად ხდება მონაწილე ატომების დამუხტვდა და მათგან იონების წარმოქმნა A+ და B-.
| ნახ. 4 ზოგადი ფორმულა AB ნაერთის ორი განსხვავებული მექანიზმით დაყოფის ამსახველი სქემები: | |||
| 1) |
|
ნაერთის
დაშლა იონებად. წარმოიქმნებიან კათიონი:
A+
და ანიონი:
B- ცნობილია ელექტროლიტური დისოციაციის სახელით. |
|
| 2) |
|
ნაერთის
დაშლა რადიკალებად. წარმოიქმნებიან A• და B• მაღალი ქიმიური აქტივობის მქონე მატერიალური ნაწილაკები, რომელთაც არ გააჩნიათ მუხტები და სამაგიეროდ აქვთ გაუწყვილებელი ელექტრონები. |
|
ხოლო თუ დასაყოფი მოლეკულის შემადგენელი ელემენტებისათვის არ არის დამახასიათებელი ელექტრონების გაცემის ან მიერთებისაკენ მნიშვნელოვანი სწრაფვა, მაშინ, დაყოფა მოხდება თითოეული მონაწილის ნეიტრალური მუხტის შენარჩუნებით, იმის გამო, რომ მოცემული პროცესის დროს არ ხდება ელექტრონთა პარტნიორი ატომების შემადგენლობაში გადასვლა (ნახ. 4, მაგ. 2) და მიიღებიან ნაწილაკები, რომელთაც რადიკალები ეწოდებათ A• და B•. ამ მექანიზმით მოლეკულები იშლებიან, უპირატესად კოვალენტური ბმების გახლეჩის შემთხვევაში.
ჰომოლოგიური რიგი
მოგეხსენებათ, რომ ელემენტები წყალბადი და ნახშირბადი გამოირჩევიან ელექტრონების გაცემის ან მიერთების უპირატესობების არ ქონით. ზემოაღნიშნული ხასიათი განაპირობებს იმას, რომ ნახშირწყალბადების მოლეკულების დაშლა ხდება არა იონების მიღებით არამედ რადიკალების წარმოქმნით.
ნახ. 5-ში მოყვანილია ცხრილი ნახშირწყალბადების შესაბამისი ნაერთების დახასიათებით:
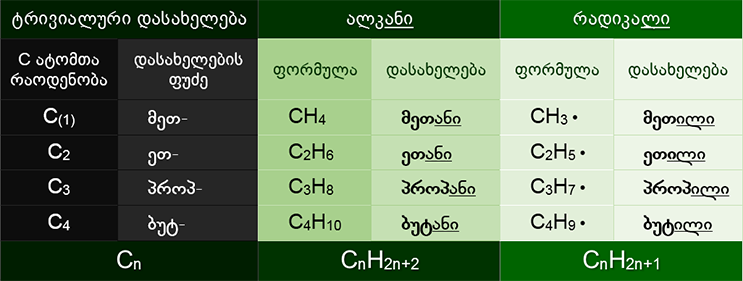 |
| ნახ. 5 ნახშირწყალბადოვანი ნაერთების ჰომოლოგიური რიგი. |
ნახშირწყალბადების
ქიმიური თვისებები
ჟანგბადში წვა
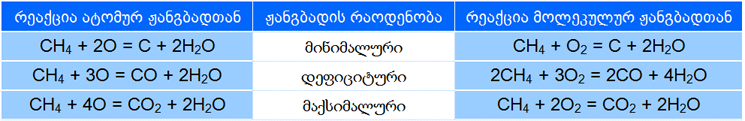
ყველა ნახშირწყალბადისათვის ძირითადად დამახასიათებელია ჟანგბადში წვის რეაქციები, რომელთა შედეგად ჟანგბადნაერთი პროდუქტები მიიღებიან. კერძოდ, წვის დროს წარმოქმნილი თბური ენერგია შლის ნახშირწყალბადს შემადგენელ ელემენტებად (ნახ. 6) და შემდგომ ჟანგბადი თითოეულთან წარმოქმნის ოქსიდებს. ასე ჭარბად აღებულ ჟანგბადში ნახშირწყალბადის წვის შედეგად მიიღებიან მისი შემადგენელი ელემენტების, ნახშირბადის და წყალბადის ოქსიდები. მაგალითად, ბუნებრივი აირის, მეთანის წვა ჰაერზე:
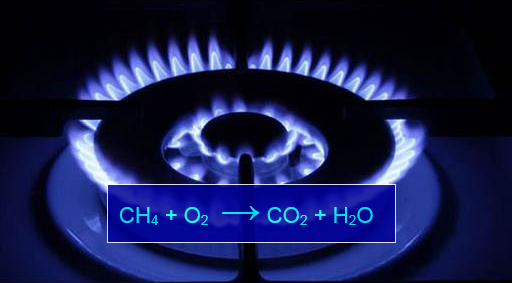
მოცემული რეაქცია მიმდინარეობს შემდეგი სტადიებით:
| რეაქციის კერაში 1950 °C-მდე: | CH4 → C• + 4H• | |
| პროცესში ჟანგბადის ჩართვა: | 1) H• + O → H2O | |
| 2) C• + O → CO2 | ||
|
ნახ. 6 ნახშირწყალბადის ჟანგბადში წვის რეაქციის სტადიების ზოგადი სქემა |
||
ნახშრწყალბადის წვის რეაქცია შესაძლოა მიმდინარეობდეს, არა მხოლოდ ჟანგბადის ადექვატური რაოდენობის მოწოდების პორობებში, არამედ ასევე მისი დეფიციტისას. წვის პროდუქტები მიიღებიან დახარჯული ჟანგბადის რაოდენობასთან შესაბამისობაში. ნახშირწყალბადებში პირველ რიგში იწვის წყალბადი, რომლის შემედეგ დგება ნახშირბადის ჯერი. ნახშირწყალბადების არასრული წვის (ჟანგბად დეფიციტურ) პირობებში წარმოიქნებიან, როგორც თავისუფალი ნახშირბადი ასევე მისი 'არასრული' ოქსიდები, ამ ელემენტის უმცირესი ვალენტობით: ნახშირბად (II) ოქსიდი - ნახშირბად (IV) ნაცვლად (ნახ. 7)
 |
|
ნახ. 7 ნახშირწყალბადის ჟანგბადში წვის რეაქციის სტადიების თანმიმდევრული სქემა |
ჩანაცვლების რეაქციები ნაჯერ ნახშირწყალბადებში
ალკანების ჰალოგენირება
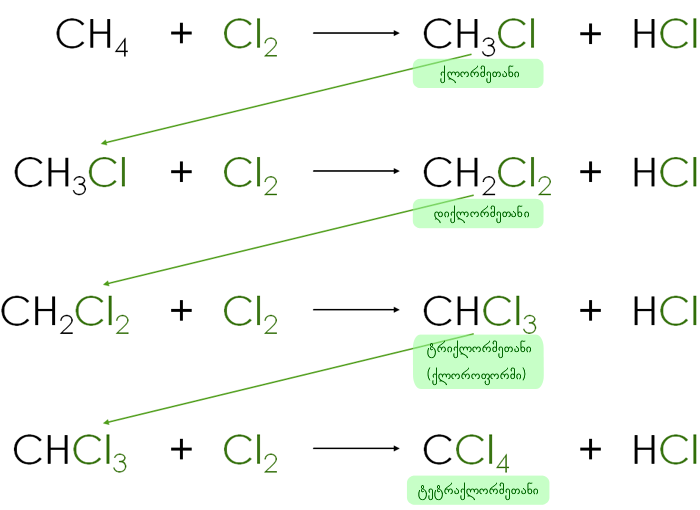
ნაჯერი ნახშირწყალბადების მოლეკულური სტრუქტურის მიხედვით მასში შემავალი ყველა ელემენტის ატომებს გამოყენებული აქვთ თავიანთი ვალენტობები სხვა ატომებთან დასაკავშირებლად ზღვრულად შესაძლო რაოდენობით ანუ მათმა რიცხვმა მიაღწია კავშირების დამყარების შესაძლებლობის მაქსიმუმს - გაჯერებულია. ამის გამო არ გახლავთ შესაძლებელი მათი მიერთების რეაქციებში მონაწილეობა. სამაგიეროდ ამ კლასის ნაერთებისათვის (ნაჯერი ნახშირწყალბადებისათვის) დამახასიათებელია ჩანაცვლების რეაქციები, რომელიც მდგომარეობს მათ მოლეკულებში წყალბადატომების სხვა ელემენტების ატომებით ჩანაცვლებაში (ნახ. 8 და ნახ. 9).
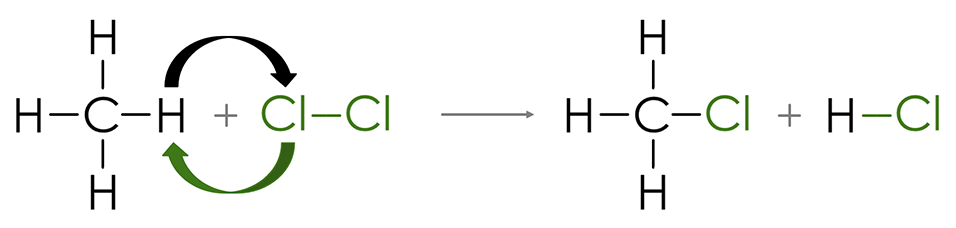 |
|
ნახ. 8 ნაჯერ ნახშირწყალდაბედში ჩანაცვლების რეაქციების სქემა მეთანის ქლორირების მაგალითზე |

 |
|
ნახ. 9 მეთანის სრული ქლორირების რეაქციის ეტაპობრივი სქემა |
ნაჯერი
ნახშირწყალბადების ქიმიური თვისებები:
სხვა დამახასიათებელი რეაქციები
ასევე ალკანთა ქიმიურ თვისებებს შორის საჭიროა აღინიშნოს რიგი რეაქციები რომლებიც მოცემულ სახელმძღვანელო კონსპექტში მოყვანილია მხოლოდ გაცნობის მიზნით და სცდებიან სასწავლო კურსს, ამიტომ ნახ. 9-ში მოყვანილი მაგალითების დასწავლა არ გახლავთ სავალდებულო.
|
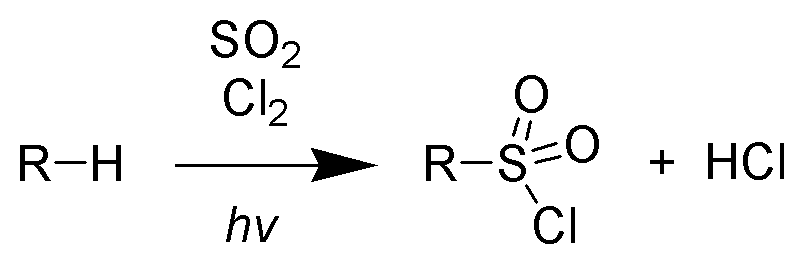
ცნობისათვის: 1) ალკანის სულფოქლორირება (რიდის რეაქცია)
2) ალკანის ნიტრირება (კონოვალოვის რეაქცია)
3) ალკანის დაჟანგვა (კატალიზური)
4) ალკანის თერმოლიზი (დაშლა)
5) ალკანის კრეკინგი (პიროლიზი)
|
|
ნახ. 9 ნაჯერი ნახშირწყალბადების ქიმიური თვისებები: ალკანების მახასიათებელი დამატებითი რეაქციები (არ გახლავთ სავალდებულო დასწავლისათვის) |