8) ქიმიური ბმები (იონური და კოვალენტური)
მოლეკულებში ატომების უნარი თავისკენ წაანაცვლონ საკავშირო ელექტრონები განიზომება სიდიდით, რომელსაც ეწოდა ელექტროუარყოფითობა. სხვა სიტყვებით, ელექტროუარყოფითობით ხდება ელექტრონის მიმართ სწრაფვის რაოდენობრივი დახასიათება. მატერიალურ ნაწილაკთა აღნიშნულ ატრიბუტს გააჩნია ფუნდამენტური მნიშვნელობა ატომის ქიმიური თვისებებისათვის.
|
ელექტროუარყოფითობა:
არის ატომის უნარი თავისი გარე გარსის შევსებისათვის მიიზიდოს მეზობელი ატომის ელექტრონები. რაც უფრო მეტად აქვს გამოხატული ელემენტს ეს უნარი, მით მეტია მისი ელექტროუარყოფითობა. |
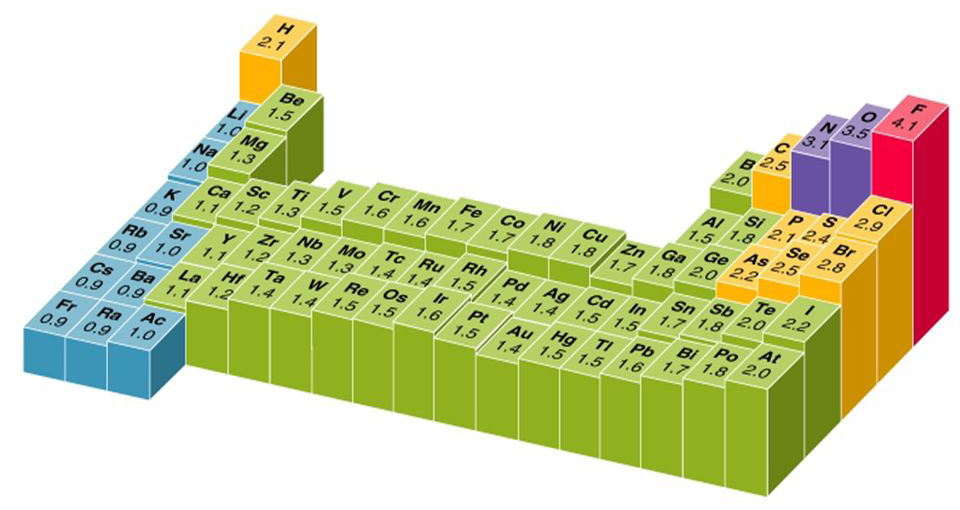
ნახ 5. - ქიმიურ ელემენტთა ელექტროუარყოფითობის ამსახველი დიაგრამა.
ყველაზე დაბალი გააჩნია ფრანციუმის ატომს χ (Fr) = 0,9; ყველაზე მაღალი კი ფტორის ატომს χ (F) = 4,1.
|
|
განხილული პრეზენტაცია ¹3 |
|
||||||||
|
|
|
|||||||||
|
|
||||||||||
ატომებს შორის
კავშირის დამყარების ორ ძირითად შესაძლო შემთხვევას ვიხილავთ:
იონურსა და
კოვალენტურ ბმებს.
|
იონური ბმა: (ძვ. ბერძ. ίόν — გადმოსული; გადაღმა). ქიმიური კავშირი, რომელიც წარმოიქმნება უკიდურესად განსხვავებული ელექტროუარყოფითობის მქონე ატომებს შორის. ძლიერ ლითონსა და ძლიერ არალითონს შორის, რომლის დროსაც გაზიარებული (სავალენტო) ელექტრონები ერთი ატომიდან მთლიანად გადადიან მეორე ატომის შემადგენლობაში. |
|
კოვალენტური ბმა:
(ლათ. co-"ერთობლივი; თანაგაზიარება" და vales - "ძალის მქონე"). ამ სახით დამყარებულ ბმაში სავალენტო ელექტრონები მოძრაობენ ყველა, კავშირში მონაწილე, ატომების ბირთვების ირგვლივ, რომელიმე მათგანზე ლოკალიზაციის გარეშე. აღნიშნული ელექტრონები დიდი სიხშირით და განუწყვეტლივ გადადიან ერთი ატომის შემადგენლობიდან მეორეში (და არ ჩერდებიან, რომელიმე მათგანზე). |
ამგვარად, იონური კავშირის მქონე ნაერთებისათვის დამახასიათებელია პოლარულ ("დამუხტულ") გამხსნელებში კარგი ხსნადობა, ისეთებში როგორც არიან წყალი, მჟავეები ა.შ. რაც არის განპირობებული თავად იონური ნაერთის დამუხტულობის გამო.
ტიპიური კოვალენტური კავშირის მქონე ნაერთევისათვის კი დამახასიათებელია წყალში უხსნადობა და ლიპოფილური ბუნების მქონე გამხსნელებში ხსნადობა (მაგალითად ზეთებში, ცხიმებში, ორგანულ გამხსნელებში).
|
მოცემულ ბლოკში
მოყვანილი გასაზღვრება წარმოდგენილია გამარტივებულად
და მიზნად ისახავს საკითხის მხოლოდ პრინციპების
შემეცნებას, რაც მასთან დაკავშირებულ სავარჯიშოების შესრულების
მნიშვნელოვნად აადვილებს. ამრიგად საგულისხმოა, რომ
კოველენტურ ბმებს თუ
დავყოფთ სამ დივიზიად, გამოვა: |
9) ჟანგვა-აღდგენის საფუძვლები (პრინციპი)
ჟანგვა-აღდგენით რეაქციები მიმდინარეობენ მონაწილე ელემენტების ჟანგვის ხარისხის შეცვლით. ეს ხორციელდება ელექტრონთა გადანაწილებით რეაქციაში მონაწილე ელემენტ-დამჟანგველს და ელემენტ-აღმდგენელს შორის. დამჟანგველები ელექტრონებს იერთებენ, აღმდგენელები - გასცემენ. ელემენტარულ, მარტივ ნივთიერებებს შორის ტიპიური აღმდგენელები არიან ლითონები, მათთვის დამახასიათებელია ელექტრონების გაცემა. შესაბამისად დამჟანგველისათვის, პირიქით, დამახასიათებელია ელექტრონების მიღება, მათი ტიპიური წარმომადგენლები არიან არალითონები.
|
დაჟანგვის პროცესი გულისხმობს ელექტრონთა გადასვლას. ამრიგად: თუ ობიექტმა* დაკარგა ელექტრონი ის დაიჟანგა, ხოლო თუ შეიძინა ელექტრონები - აღდგა. |
|
| * - ობიექტად მოისაზრება ნივთიერების (მატერიალური) ნაწილაკები, როგორიცაა ატომი, მოლეკულა, იონი. |
აქვე საჭიროა შედარებითობის ფორმატში განიმარტოს ზემოთ აღნიშნული ნივთიერების ნაწილაკები:
|
ატომი: ქიმიური ელემენტის წარმომადგენელი უმცირესი ნივთიერი ნაწილაკი. შედგება თანაბარი რაოდენობის პროტონებისა და ელექტრონებისაგან, რის გამოც ყოველთვის გახლავთ ელექტრულად ნეიტრალური, ამიტომ მათი ჟანგვის ხარისხის აღნიშვნის საჭიროების შემთხვევაში ეწერებათ მუხტი 0. მაგ. Fe0, K0, Si0 მოლეკულა: ატომთა ურთიერთდაკავშირებით მიღებული ნივთიერების უმცირესი ერთეული. ასევე არის ელექტრულად ნეიტრალური.
იონი:
ელექტრულად დამუხტული ატომი ან მოლეკულა, რომელიც წარმოიქმნება მის
მიერ ელექტრონების დაკარგვის ან ჭარბად შეძენის შედეგად.
იონების გარდაუვალი დამუხტულობის გამო, მათ ყოველთვის ეწერებათ
ნიშნიანი დაჟანგვის ხარისხი (+) ან (‒). |
ელექტრონი გახლავთ უარყოფითად დამუხტული. შესაბამისად მისი A-სისტემიდან B-სისტემაში გადასვლის შედეგად ხდება B-ს გაუარყოფითება, რასაც ერთდროულად მოსდევს A-ს გადადებითება.
როგორც უკვე ნათელი გახდა სხვადასხვა ქიმიურ ელემენტს გააჩნია განსხვავებული ელექტროუარყოფითობა (ელექტრონებისადმი სწრაფვა), რაც თავის მხრივ ხდება მატერიალური ნაწილაკების შემოდგომი ყოფაქცევის საფუძველი. ასე ცხადია, რომ ელექტროუარყოფითობის ზრდასთან ერთად მატულობს დამჟანგველი თვისებებიც.
ამრიგად აღსანიშნავია, რომ პროცესი, რომელშიც ადგილი აქვს დაჟანგვას არ მიმდინარეობს ცალმხრივად. მას ყოველთვის მოჰყვება ერთი ობიექტის მიერ ელექტრონის დაკარგვა (დაჟანგვა) და ამ ელექტრონის შეძენა მეორე ობიექტის მიერ (აღდგენა). სწორედ ამიტომ ამ შეუღლებულ პროცესს ეწოდება ჟანგვა-აღდგენა. დასამახსოვრებელია, დასკვნის სახით, რომ თუ რაიმე აღდგა ეს აუცილებლად მოხდა რაიმეს დაჟანგვის ხარჯზე.
მატერიალური ნაწილაკის
აღმნიშვნელ ფორმულაში ჩნდება უარყოფითი მუხტის ნიშნანი თუკი ადგილი აქვს
მის მიერ ელექტრონის შეძენას. უარყოფითი ნიშანი იზრდება შეძენილ ელექტრონთა
რაოდენობის შესაბამისად.
ასე მაგალითად, ჟანგბადის ატომის
მიერ ერთი ელექტრონის შეძენის შედეგად
მიღებულ იონს ექნება
მუხტი
მინუს ერთი:
O0 + 1ē
→
O‒1,
საგულისხმოა, რომ კორექტულ ფორმულირებაში მუხტთან და ინდექსთან 1-იანი არ
იწერება და სწორი ჩანაწერი იქნება O0 +
1ē
→
O‒.
იმის გამო, რომ ჟანგბადის ატომს აქვს უნარი საბოლოო ჯამში მიიერთოს ორი
ელექტრონი, მისთვის დამახასიათებელი იქნება მეორე ელექტრონის მიერთებაც:
O‒ + 1ē
→
O2‒.
ხოლო რაც შეეხება ელექტრონთა გაცემას,
ამას ბუნებრივია მოჰყვება, ლოკალურად დადებითი მუხტის გაჩენა და
ზრდა თითოეულ გაცემულ ელექტრონთან ერთად, მაგ.:
►
Cl0 ‒ 1ē
→
Cl+
►
Cl+ ‒ 1ē
→
Cl2+
►
Cl2+ ‒ 1ē
→
Cl3+
|
|
განხილული პრეზენტაცია ¹4 |
|
||||||||
|
|
|
|||||||||
|
|
||||||||||
როგორც უკვე ითქვა
ჟანგვა-აღდგენით
რეაქციები მიმდინარეობენ მონაწილე
ელემენტების
ჟანგვის ხარისხის
შეცვლით. კონკრეტული რეაქციის სურათის წარმოდგენის გაუმჯობესებისათვის სასურველია მიჰყვეთ
შემდეგ ინსტრუქციას
(რომელიც წერით უნდა შეასრულოთ):
❶
აქ მოყვანილი მაგალითის
მსგავსად, რომელშიც ზოგადად მოცემულია ელემენტი
(E)
დააფიქსირეთ თქვენთივს საძიებო
კონკრეტული ელემენტი (თქვენს მაგალითში შესაბამისი ელემენტის მოყვანით) ერთგანზომილებიან საკოორდინატო
მონაკვეთზე.
ზოგადი სქემა გამოდის:
Eა
→
Eბ,
რომელშიც
ჟანგვის ხარისხები იგულისხმებიან შესაბამისად, როგორც საწყისი
(Eა) და საბოლოო
(Eბ)
ნახ. 6-1 და ნახ.
6-2;
❷ დაფიქსირებულ ჟანგვის ხარისხებს შორის გადასვლისათვის ბიჯების რიცხვი უდრის ამ პროცესში მონაწილე ელექტრონების რაოდენობას.
❸ ამასთან
საკოორდინატო მონაკვეთზე
(Eა)
თუ
(Eბ)
ურთიერთგანლაგების მიმდევრობა გვიჩვენებს პროცესის მიმართულებას.
თუ
(Eა)
განლაგებულია
(Eბ)-თან
შედარებით უფრო მარცხნივ (მონაკვეთის შედარებით უარყოფით მხარეს)
ადგილი აქვს ჟანგვას.
თუ
(Eა)
განლაგებულია
(Eბ)-თან
შედარებით უფრო მარჯვნივ (მონაკვეთის შედარებით დადებით მხარეს)
ადგილი აქვს აღდგენას.
|
|
ნახ.6‒1 |
ელემენტის დაჟანგვის გამოსახვა გრაფიკული სქემით. |
|
|
|
|
||
 |
|||
ნახ. 6-1. მოცემულ მაგალითში ელემენტის ჟანგვის ხარისხის უფრო დადებითი მაჩვენებლისაკენ გადადის. სქემაში ნაჩვენებია, რომ ჟანგვის ხარისხის (‒3)-დან (+2)-ზე გარდაქმნას ესაჭიროება 5 ელექტრონის მონაწილეობა. რომელიც ელემენტის მიერ ელექტრონთა გაცემის გამო გადადებითდა.
|
|
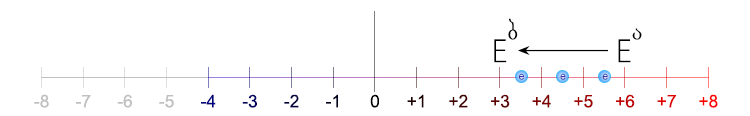
ნახ.6‒2 |
ელემენტის აღდგენის გამოსახვა გრაფიკული სქემით. |
|
|
|
|
||
 |
|||
ნახ. 6-2. მოცემულ მაგალითში ელემენტის ჟანგვის ხარისხის უფრო უარყოფითი მაჩვენებლისაკენ გადადის. სქემაში ნაჩვენებია, რომ ჟანგვის ხარისხის (+6)-დან (+3)-ზე გარდაქმნას ესაჭიროება 3 ელექტრონის მონაწილეობა. რომელიც ელემენტის მიერ ელექტრონთა გარედან მიერთების გამო შედარებით გაუარყოფითდა.
|
|
საშინაო დავალება: |
|
||||||||
|
|
|
|||||||||
|
|
||||||||||
განხილული საკითხებიდან გამომდინარე შესაძლოა გაკეთდეს მიგნებები, რომლებიც განმარტებულია ქვემოთ მოცემულ ნახ. 7-ში
|
|
ნახ.7 |
ელემენტის აღმდგენი და დამჟანგველი თვისებებისათვის დამახასიათებელი თანმდევი ნიშნები. |
|
||||||||||||||||||
|
|
|
||||||||||||||||||||
|
|
|||||||||||||||||||||


